2025年6~9月份,我院曹飞课题组持续在天然药物化学领域取得系列成果,在Food Packaging and Shelf Life(中科院一区,IF=10.6)、Postharvest Biology and Technology(中科院一区)、Pesticide Biochemistry and Physiology(中科院一区)、Natural Products and Bioprospecting、Tetrahedron、Chemistry & Biodiversity、Pharmacological Research - Modern Chinese Medicine等权威学术期刊上发表了一系列研究论文,简要回顾如下。
01.海洋来源球毛壳菌中新颖结构杂二聚体类化合物研究
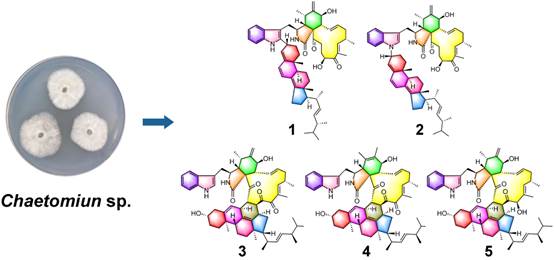
天然产物“杂二聚体”因骨架互补与潜在协同活性,兼具结构新颖性与成药可能,是新药先导物的重要来源。该研究自海洋来源真菌Chaetomium sp.获得5个新型chaetoglobosin–甾醇杂二聚体(Chalasoergodimers A–E)及3个已知体,揭示多通路二聚。Chalasoergodimer A为首次C-2′/C-3″成键,chalasoergodimer B为首例NH-1′取代且C-3″为R构型,chalasoergodimers C–E源于与14-去氢麦角甾醇的Diels–Alder加成。部分化合物展现抗肿瘤潜力,为chaetoglobosin–甾醇化学与药物发现提供新线索,并以多谱学与计算方法确定构型,提出生合设想,为多靶点药效开发提供线索。该论文发表于天然产物经典期刊Natural Products and Bioprospecting, 2025, 15: 61。原文链接:https://link.springer.com/article/10.1007/s13659-025-00544-5
02. 基于破坏膜稳态、触发氧化应激并抑制能量代谢的厚朴精油多靶点抗真菌作用机制研究
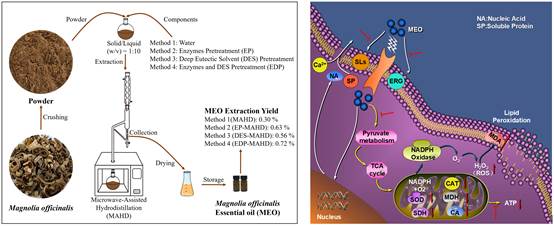
该研究采用酶法与低共熔溶剂(DES)联合预处理,并结合微波辅助水蒸馏(EDP-MAHD)提取中药厚朴精油(MEO)。经GC-MS分析共鉴定出41种挥发性成分,其中以β-榄香烯醇为主,同时检测到石竹烯氧化物与hinesol等。抗真菌机制研究发现,MEO抑制甘油磷脂与麦角甾醇生物合成,破坏细胞膜稳态并显著提升通透性,随之出现电解质与可溶性蛋白外渗;同时诱发ROS与H₂O₂快速累积并削弱SOD/CAT等抗氧化防线,脂质过氧化加剧而引发氧化失衡;进一步干扰线粒体功能与三羧酸循环关键酶,导致ATP与ATPase水平下降,能量供给受限。SEM/TEM形貌学证据与4D-DIA蛋白组学共同印证上述通路,揭示“膜破坏—氧化应激—能量枯竭”的连续打击机制。MEO在体外展现出显著抗真菌活性,显示其作为天然、低残留的绿色抑菌候选的应用潜力。该论文发表于中科院一区期刊Postharvest Biology and Technology, 2026, 231: 113914。原文链接:https://www.sciencedirect.com/science/article/pii/S0925521425005265
03. 海洋二萜Diaporthein B-ZnO/壳聚糖复合膜及多靶点抗真菌作用
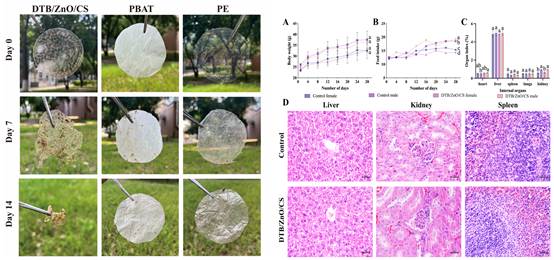
海洋天然产物是新型抑菌材料的重要来源与创新引擎。该研究将海洋二萜Diaporthein B(DTB)与纳米氧化锌嵌入壳聚糖,制备可降解DTB/ZnO/CS活性膜,兼具抑菌与保质功能。多尺度表征(XRD/FT-IR/SEM/AFM)显示DTB有序嵌入并形成微纳结构,提升膜的力学韧性、热稳定与表面润湿性,利于活性接触与缓释。机理上,材料扰动真菌细胞膜稳态、提高通透性,诱发ROS压力并削弱抗氧化防线,同时抑制线粒体能量代谢与ATP合成,形成“膜应激—氧化失衡—能量枯竭”的连续打击,从而显著抑制真菌生长与扩散风险。该复合膜环境可降解、生物相容性良好,为“海洋天然产物×纳米材料×生物高分子”的绿色包装提供可实施方案。该论文发表于中科院一区期刊Food Packaging and Shelf Life, 2025, 51: 101586。原文链接:https://www.sciencedirect.com/science/article/abs/pii/S2214289425001565?via%3Dihub
04. 海洋真菌吲哚二萜二聚体的发掘及抑制脂肪生成作用研究
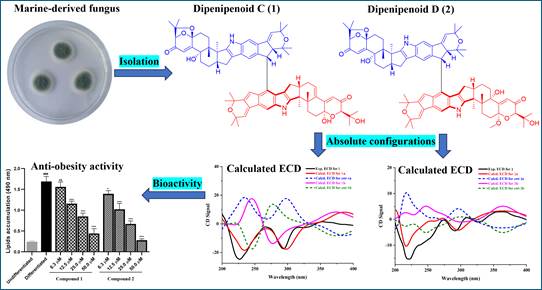
代谢性疾病亟需来源多样、结构新颖的小分子先导化合物,海洋真菌二聚天然产物因奇特成键与多位点作用被视为重要突破口。该研究在Penicillium sp. CF-06发酵中加入2% MgCl₂实现定向二聚,获得二聚吲哚-二萜dipenipenoids C、D。采用HRESIMS、1D/2D-NMR、NOESY解析骨架,结合TD-DFT/ECD确证绝对构型;两者经C-20–C-22′连接,拓展该类分子的立体化学与可能生源路径。功能评估显示,在3T3-L1细胞中dipenipenoids C、D以6.3–50 μM剂量显著抑制脂滴累积,且100 μM未见细胞毒性。研究贯通“发酵调控—结构确证—功能验证”,为抗肥胖与代谢紊乱干预提供新先导与化学空间。该论文发表于天然产物经典期刊Tetrahedron, 2025, 185: 134850。原文链接:https://www.sciencedirect.com/science/article/abs/pii/S0040402025004065?via%3Dihub
05. 海洋真菌Epicoccum nigrum Q8-1生物防控潜力与作用机制
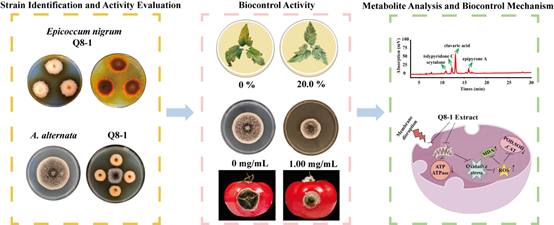
海洋真菌处于盐压、温梯度与共生—拮抗等独特生态位,驱动次级代谢基因簇多样化,持续产出生化新颖、作用多位点且可持续获取的天然化合物,是绿色抗真菌先导的重要源泉。该研究报道了海洋来源真菌Epicoccum nigrum Q8-1的抗真菌潜力与机制。研究表明:粗提物显著抑制真菌生长并延缓病程;机制上同时抑制麦角甾醇生物合成、破坏细胞膜通透屏障,诱发ROS/H₂O₂积累并削弱SOD/CAT防线,进一步降低ATP与ATPase活性,触发程序化死亡,形成“膜稳态受损—氧化应激—能量枯竭”的连续打击。全基因组解析揭示多条次级代谢基因簇,LC-MS/MS检出tolypyridone C、epipyrone A、scytalone等候选活性分子,为海洋真菌源绿色抑菌制剂开发奠定物质与机制基础。该论文发表于中科院一区期刊Pesticide Biochemistry and Physiology, 2025, 213: 106552。原文链接:https://www.sciencedirect.com/science/article/abs/pii/S0048357525002652?via%3Dihub
06. 海洋来源Penicillium sp.中聚酮类化合物及α-糖苷酶抑制活性
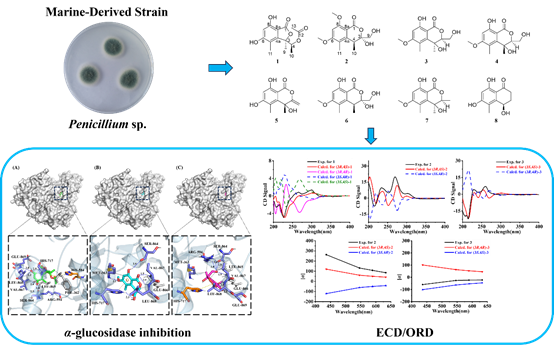
海洋真菌在盐压与共生拮抗等生态压力下演化出独特代谢网络,提供可规模发酵、结构新颖的药物先导物。该研究以渤海来源真菌Penicillium sp.为对象,分离鉴定3个新化合物(1个异苯并呋喃酮、2个异色原酮)及5个已知多酮;通过HRESIMS、1D/2D-NMR、ORD/ECD与TD-DFT计算确证骨架与绝对构型。功能评估显示,其中1、3、4对α-糖苷酶具有抑制活性(IC50=76.4、95.4、88.3 μM),与阳性对照阿卡波糖相当;分子对接揭示其在活性位点通过多氢键与疏水作用形成稳定结合,支撑其抑酶机制。该研究构建“海洋真菌→发酵获取→结构确证→作用机理”的全链路,拓展α-糖苷酶抑制剂的化学空间,凸显海洋真菌代谢产物在代谢性疾病干预中的应用潜力。该论文发表于期刊Chemistry & Biodiversity, 2025, 0: e01466。原文链接:https://onlinelibrary.wiley.com/doi/10.1002/cbdv.202501466
07. 靶向PI3K-Akt/JAK-STAT/MAPK的中药五加皮抗膜性肾小球肾炎作用机制研究
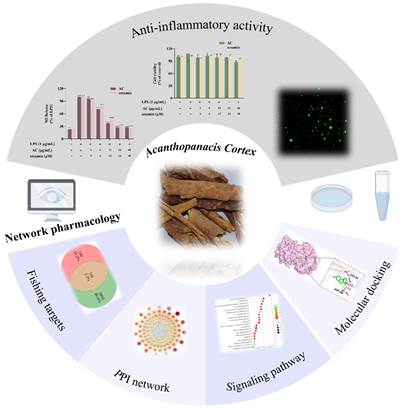
膜性肾小球肾炎(MGN)致肾衰风险高、现有免疫抑制疗法副作用重,亟需多靶点且更安全的干预。该研究以五加皮(Acanthopanacis Cortex)为对象,结合网络药理与实验验证,阐明其抗MGN的物质基础与作用网络:整合文献与数据库筛得15种活性成分,对应409个潜在靶点,与疾病集合交叠得到109个关键基因;PPI与KEGG/GO富集指向PI3K-Akt、JAK-STAT、MAPK等核心通路,分子对接支持芝麻素、二萜酸与甾醇类等与ESR1、JAK2、MAPK14等稳定结合。细胞层面,在LPS诱导的RAW264.7炎症模型中,五加皮提取物及芝麻素在无毒剂量下显著降低NO释放、抑制COX-2/iNOS并缓解ROS累积,提示通过抑炎、抗氧化与免疫稳态重建实现协同保护。研究为中药五加皮用于MGN的精准用药与后续体内验证提供理论依据与候选化学线索。该论文发表于期刊Pharmacological Research - Modern Chinese Medicine, 2025, 15: 100632。原文链接:https://www.sciencedirect.com/science/article/pii/S2667142525000612?via%3Dihub
相关文献:
1.Z. H. Lin, H. W. Shan, L. K. Yang, T. T. Sun, L. Y. He, H. F. Du, Y. H. Zhang, S. Liu, X. Wang, D. Q. Luo and F. Cao, Chalasoergodimers A–E, heterodimers with multiple polymerization modes from a marine-derived Chaetomium sp. fungus, Nat. Prod. Bioprospect., 2025, 15, 62.
2.Y. F. Liu, X. Y. Tong, Z. H. Xu, Y. X. Gao, F. Cao and Y. H. Zhang, Postharvest management of kiwifruit soft rot caused by Botryosphaeria dothidea using Magnolia officinalis essential oil: Composition, efficacy, and mechanism, Postharvest Biol. Technol., 2026, 231, 113914.
3.H. F. Du, F. Cao, Z. H. Xu, Y. X. Gao, Y. H. Zhang, S. Pang, W. Li, L. F. Li, L. Han, L. J. Wang and H. D. An, Diaporthein B/ZnO/chitosan biodegradable film for postharvest preservation of apples: Characterization and application, Food Packag. Shelf Life, 2025, 51, 101586.
4.Q. S. Wang, W. B. Gao, H. Y. Gu, Z. Q. Liu and F. Cao, Dipenipenoids C and D, new dimeric indole-diterpenoids from the marine-derived fungus Penicillium sp. CF-06, Tetrahedron, 2025, 185, 134850.
5.S. Q. Fu, F. Cao, S. Pang, X. Q. Qi, Z. H. Xu, Y. H. Zhang, Z. C. Liu, D. Q. Luo and Y. F. Liu, The biocontrol effect and mechanism of the marine-derived fungus Epicoccum nigrum against Alternaria alternata, the causal agent of tomato black spot disease, Pestic. Biochem. Physiol., 2025, 213, 106552.
6.X. Wang, Z. H. Lin, S. Liu, Q. S. Wang, B. Wang, Y. H. Zhang, S. S. Liu, L. J. Wang and F. Cao, Bioactive isobenzofuranone and isochromenones from a marine-derived fungus Penicillium sp.: Isolation, characterization, and inhibitory activity against α-glucosidase, Chem. Biodivers., 2025, e202501466.
7.S. Liu, Z. Dong, H. Y. Gu, Y. M. Xiong, W. Su and F. Cao, Exploration of the anti-membranous glomerulonephritis mechanism of Acanthopanacis Cortex using network pharmacology and experimental verification, Pharmacol. Res. Mod. Chin. Med., 2025, 15, 100632.