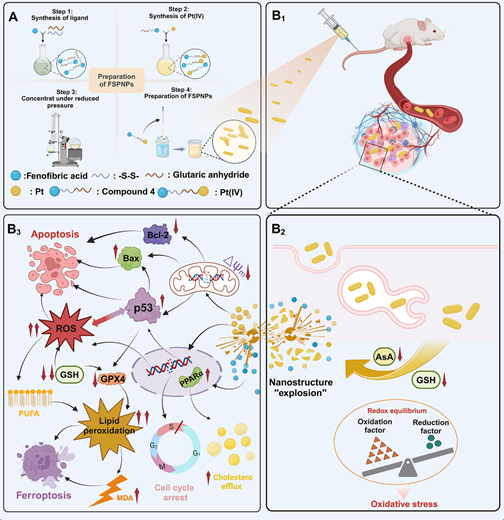
细胞凋亡是程序性细胞死亡(PCD)的一种常见形式。然而,由于肿瘤细胞的复杂性、多样性和异质性,单一基于细胞凋亡的抗癌方法往往无法达到满意的治疗效果。铁死亡作为一种以铁依赖性脂质过氧化为特征的新型PCD,已经成为癌症治疗领域的热门话题。尽管一些基于铁死亡的小分子诱导剂正在被开发,但在药物递送、肿瘤特异性和体内循环等方面的问题仍待解决。有趣的是,细胞凋亡与铁死亡之间存在着复杂的信号通路和调控因子。在一定条件下,凋亡可转化为铁死亡,反之,铁死亡也可增加细胞对凋亡的易感性。因此,如何巧妙地设计联合治疗策略和精准的释放药物已成为当前铁死亡协同细胞凋亡治疗的主要挑战。另一方面,Pt(II)类药物在临床癌症治疗中占有重要地位,但也存在副作用大和易耐药两大固有挑战,因此迫切需要开发新的治疗方式以克服上述不足。
针对上述问题,我院青年教师宋雪晴博士与李龙飞副教授合作,构建了一系列用于细胞凋亡/铁死亡协同肿瘤治疗的精确无载体Pt(IV)-纳米炸弹,获得了良好治疗效果,并降低了系统毒性。相关成果以“Precise Carrier-Free Pt(IV)-Nanobombs for Apoptosis/Ferroptosis Synergistic Tumor Therapy: A New Effective Method to Obtain Good Chemotherapy and Low Toxicity”为题发表在药学权威期刊Journal of Medicinal Chemistry(中科院双一区TOP,IF: 6.8)上(原文链接https://doi.org/10.1021/acs.jmedchem.4c02034)。
该项工作通过将非诺贝酸(FA)与具有二硫键的顺铂或奥沙利铂衍生的Pt(IV)中间体相连接,构建了一系列具有脂质调节作用的新型无载体自组装Pt(IV)纳米颗粒,即FSPNPs(5NPs-8NPs)。该FSPNPs在受到高浓度的还原物质如谷胱甘肽(GSH)/抗坏血酸(AsA)等以及酸性环境的刺激后,会产生“爆炸状”的级联释放过程。细胞活性研究显示,FSPNPs具有优于顺铂的肿瘤细胞选择性,可以更多的靶向肿瘤细胞,并有效抑制肿瘤细胞增殖,克服细胞对顺铂的耐药性。机制研究证实,FSPNPs能够下调GSH/GPX4,增加细胞内活性氧/脂质过氧化物/丙二醛的水平,诱导严重的DNA损伤/S期阻滞,调节p53/Bcl-2/Bax通路,以触发细胞凋亡/铁死亡协同通路。另外,FSPNPs在肿瘤组织中释放出的FA及其衍生物能够与过氧化物酶体增殖物激活受体α(Peroxisome proliferator-activated receptor α, PPARα)结合,激活细胞内胆固醇代谢,进而破坏细胞膜的完整性。体内实验进一步证实,FSPNPs具有良好的生物相容性和良好的抗肿瘤活性,并且对正常组织器官无明显损伤。
该研究将为精准递送的无载体Pt(IV)纳米药物的研制提供新的范例。河北大学宋雪晴博士与李龙飞副教授为本文的共同通讯作者,河北大学药学院硕士研究生郭旭和梁雪娇为共同第一作者。该研究得到了国家自然科学基金和河北省自然科学基金等项目的资助。
参考文献:
Precise carrier-free Pt(IV)-nanobombs for apoptosis/ferroptosis synergistic tumor therapy: A new effective method to obtain good chemotherapy and low toxicity. DOI: 10.1021/acs.jmedchem.4c02034.