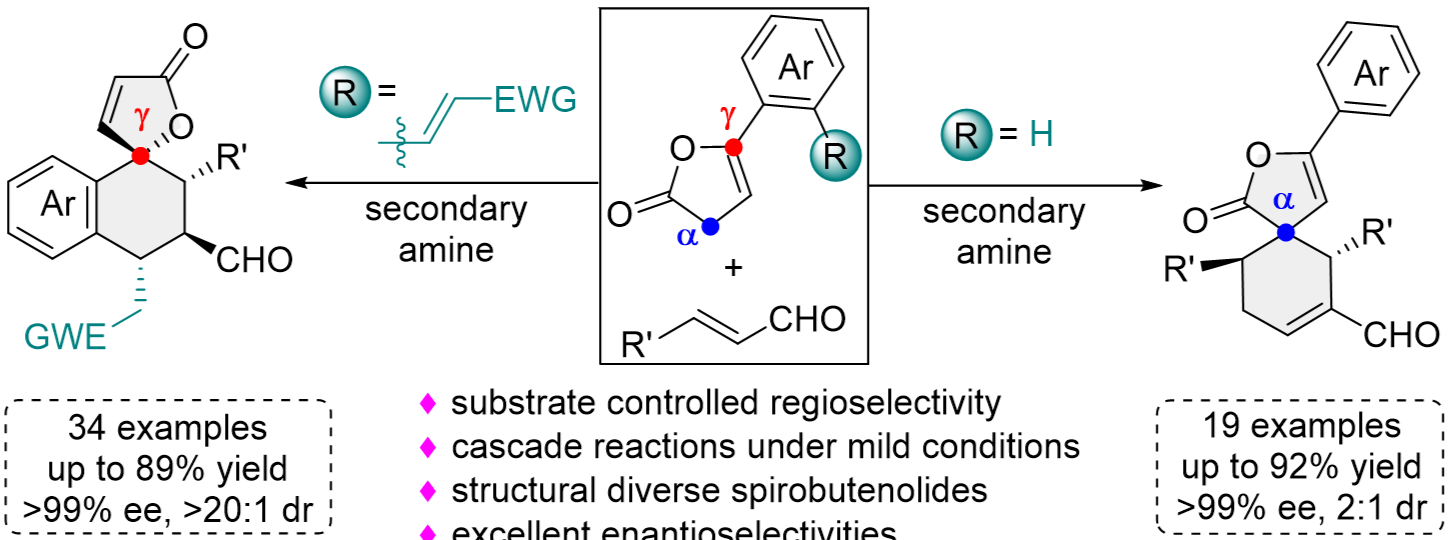
丁烯酸内酯螺环结构是天然产物中的常见骨架,多数具有该类结构的化合物表现出广泛且良好的生物活性。然而,由于螺环结构本身具有一定的刚性,同时包含全取代碳原子手性中心,位阻较大,因此,丁烯酸内酯螺环骨架的不对称合成具有一定的挑战性。近日,河北大学药学院青年教师尤志浩博士与李龙飞副教授合作,利用不同结构γ-丁烯酸内酯与肉桂醛的区域选择性串联反应,高效实现了两类不同骨架丁烯酸内酯螺环化合物的不对称合成。
本研究首先以课题组设计的多功能γ-丁烯酸内酯和肉桂醛为原料,在手性仲胺催化剂作用下,通过γ-位区域选择性诱导的vinylogous Michael/Michael串联反应,高效实现共轭丁烯酸内酯螺环化合物的不对称合成,产物的ee值最高可达99%。同时,当采用普通苯基取代的γ-丁烯酸内酯与肉桂醛反应时,结果显示反应的区域选择性主要表现在底物的α位上,并通过该位点诱导的Michael/Michael/aldol以及进一步的脱水反应,高效实现非共轭丁烯酸内酯螺环化合物的不对称合成,产物同样具有良好的收率和对映选择性(ee高达99%)。毫摩尔级放大量反应以及产物的合成转化体现了该方法潜在的应用价值。DFT计算结果验证了两种不同途径反应机理的合理性。
该研究结果以“Substrate-Controlled Regioselective Cascade Reactions of Deconjugated Butenolides and Cinnamaldehydes: Access to Structurally Diverse Spirobutenolides”为题发表在Organic Letters(中科院一区TOP,IF: 4.9)上(https://doi.org/10.1021/acs.orglett.4c02809)。
(图片来源:Org. Lett.)